



在细胞表面分布着大量的跨膜蛋白,它们构成了细胞与外界“交流沟通”的媒介。其中,G蛋白偶联受体(GPCR)是真核生物中最大、最多样的膜蛋白家族。它们通过准确地接收、解读和传递细胞外的各种信号至细胞内来调控细胞乃至机体的各种生理病理反应,以维持生命活动的正常运转。正如其名,它通过在胞质内偶联G蛋白从而介导下游信号的传导。GPCR的最大特点是具有典型的7次跨膜螺旋的结构,它们在细胞信号转导中发挥非常关键的作用,目前超过总数三成的上市药物以它作为靶标。
根据不同的生理作用及其活化因素,GPCR又可分为不同家族,其中腺苷受体包括A1R、A2AR、A2BR、A3R四个成员。它们的天然内源性配体为腺苷,而咖啡中的主要成分咖啡因则是腺苷受体的拮抗剂,它通过抑制腺苷受体的活性从而达到使人兴奋或清醒的作用。目前腺苷受体家族只有A1R和A2AR有结构报道,而对A2BR结构的认识依然缺乏。因此,A2BR结构的解析可以进一步补充对腺苷受体的配体选择性和激活机制的认识,从而针对性设计以腺苷受体为靶点的药物。为了扩展蛋白层面上对配体选择性的认识,华东师大3200威尼斯vip宋高洁实验室联合上海科技大学华甜团队首次解析出了激活态腺苷受体A2BR与Gs异源三聚体蛋白复合物的冷冻电镜结构。这项成果以“Cryo-EM structure of the human adenosine A2Breceptor-Gs signaling complex”为题,12月24日在线发表于Science Advances期刊。

A2BR作为腺苷受体家族的成员,主要在胃肠道、膀胱、肺和肥大细胞上表达,参与包括葡萄糖代谢、血管生成的诱导、某些肿瘤的生长、肠道炎症、心肌缺血、急性肺和肾损伤在内的众多生理和病理过程。为了观察生理状态下A2BR如何接受不同种类的配体并激活其下游的Gs蛋白以形成信号转导复合物,科研团队解析了腺苷受体通用激动剂NECA(一种腺苷的衍生物)和A2BR的选择激动剂BAY60-6583分别结合的A2BR-Gs复合物的结构。与NECA的复合物结构展示了腺苷受体家族成员与NECA结合时保守却具有细微差异的正构结合口袋,而该口袋的胞外延伸区域则可能造成该激动剂与A2BR的结合强度相对较弱。与同家族的A2AR受体相比,A2BR在胞外区域缺少一个联系ECL2和ECL3的盐桥,该盐桥可能像盖子一样覆盖在正构口袋上方以提高配体的停留时间继而影响结合强度。同时,研究团队通过解析BAY60-6583与A2BR的复合物结构发现,BAY60-6583不仅占据其正构口袋,其同时占据一个由螺旋1,2,7组成的次级口袋,并且通过细胞实验证实受体上的氨基酸V2506.51和N2737.36是BAY60-6583对A2BR高选择性的关键因素。研究团队同时还发现,A2BR的胞内螺旋helix8以向下倾斜的方式与G蛋白的b亚基发生相互作用,通过活性实验证实helix8的R307位突变减弱了配体的cAMP激动活性。这种helix8结构模式是否影响下游其他信号蛋白通路还有待进一步研究。
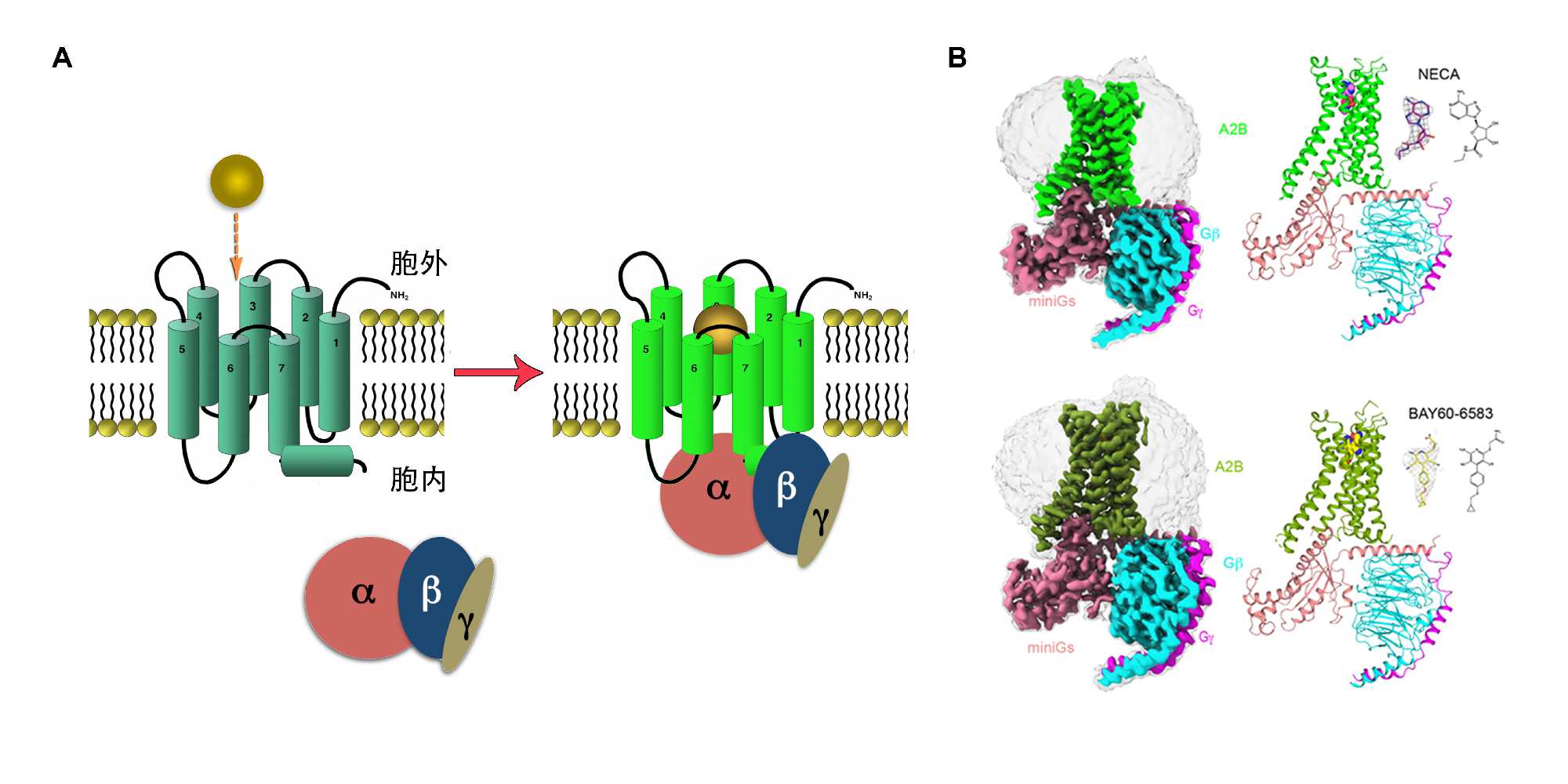
GPCR的工作模式图(A)以及两个A2BR复合物的冷冻电镜结构
目前,BAY60-6583正在用于研究动脉粥样硬化和心脏疾病的治疗,因此,通过确定A2BR中作用于激动剂BAY60-6583的特异性关键决定因素,为未来发现和开发更有效的A2BR配体提供了重要依据:为以A2BR为靶标的包括完全激动剂、偏向激动剂及多靶标激动剂等在内的药物设计和包括葡萄糖代谢、癌症、心血管疾病及急性肺肾损伤等在内的疾病治疗提供了分子层面的基础。

宋高洁实验室项目成员(自左至右:徐越明、陈颖、翁元、宋高洁)
威尼斯官网研究生陈颖、翁元以及上海科技大学iHuman研究所研究生张进一为该论文的共同第一作者,3200威尼斯vip博士后徐越明为第二作者,3200威尼斯vip为第一完成单位。3200威尼斯vip宋高洁研究员为通讯作者,上海科技大学iHuman研究所及3200威尼斯vip华甜研究员为共同通讯作者。3200威尼斯vip刘明耀教授和卢伟强研究员对本项研究提供了重要支持。参与这项研究的还有美国威斯康辛医学院的刘伟教授。
该研究受到了华师大双百人才项目、科技部重点研发计划、国家自然科学基金,以及上海市科委基础研究项目等支持。
附:
论文链接:Cryo-EM structure of the human adenosine A2Breceptor-Gs signaling complex